Sono veramente essenziali gli anticorpi contro il virus della SARS-CoV-2?
Di fronte a mutazioni continue del virus i livelli di cellule T sono in grado di rilevare, meglio degli anticorpi, le varianti mutate.
Di fronte a mutazioni continue del virus i livelli di cellule T sono in grado di rilevare, meglio degli anticorpi, le varianti mutate.

L’immunità basata sugli anticorpi è assai fragile di fronte a un virus che cambia. È questo che hanno messo in evidenza Burgers e Riou, dell’università di Città del Capo, in Sudafrica, in un lavoro in cui chiariscono l’importanza di un’altra componente del sistema immunitario, mediata da cellule T (o linfociti T), altamente specializzate nel riconoscimento degli agenti patogeni nonostante le mutazioni subite da un virus. Tutto questo mentre l’attenzione è concentrata sulla perdita della difesa anticorpale rispetto alle nuove varianti che impone il susseguirsi di richiami vaccinali sempre più ravvicinati.
Il numero di mutazioni di Omicron è doppio o triplo rispetto alle varianti precedenti, ma di fatto un’immunità parziale verso le forme gravi sembra persistere nei vaccinati. Questo sarebbe giustificato dall’intervento di un altro settore del sistema immunitario poco indagato: quello dell’immunità cellulare.
Da diversi laboratori in tutto il mondo, si sta convergendo verso la rivalutazione di questa altra linea immunologica fino ad ora trascurata.
“Il quadro che si sta delineando è che le nuove varianti rimangono fortemente suscettibili alla risposta delle cellule T – spiega Dan Barouch, direttore del Center for Virology and Vaccine Research della Harvard Medical School di Boston, nel Massachusetts – e tra quelle c’è anche Omicron”.
Vediamo di approfondire meglio come funziona il sistema immunitario.
La parola immunità deriva dal latino immunitas e si riferisce alla protezione legale di cui godevano i senatori romani in carica (immunità parlamentare).
Dal punto di vista medico, immunità vuol dire protezione dalle malattie, e in particolare dalle malattie infettive.
Il sistema immunitario è costituito da tre componenti:
◆ Cellule: Linfociti, cellule Natural Killer (NK), Cellule Dendritiche (DC), Monociti, Macrofagi, Granulociti.
◆ Tessuti: Organi linfoidi primari (centrali) e secondari (periferici).
◆ Molecole: anticorpi, citochine, fattori del complemento, proteine plasmatiche.
Le risposte immunitarie di questo ampio sistema di controllo sono di due tipi:
1) Innata o naturale, precoce (0-5gg, può attivarsi anche in pochi secondi), sempre presente, che costituisce la prima linea di difesa. Interviene subito e riconosce molecole comuni e diffuse tra microrganismi diversi. Il suo scopo è di controllare e limitare l’infezione.
2) Acquisita o adattativa, detta anche memoria immunologica (tardiva, più lenta, necessita, di alcuni giorni o settimane) che è capace di distinguere in maniera estremamente specifica le diverse molecole estranee. Essa è in grado di rispondere ad esse in modo più veloce e potente dopo contatti ripetuti.
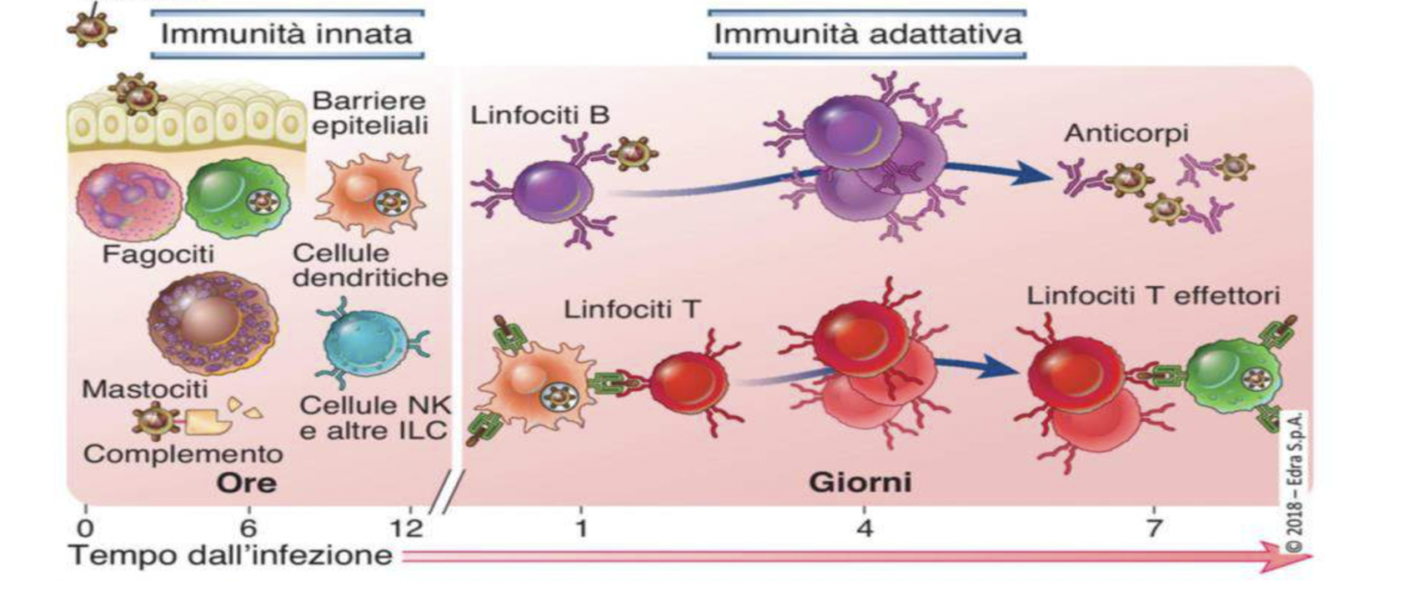
Le cellule dell’immunità innata sono quelle presenti nel conteggio della formula leucocitaria:
· Granulociti neutrofili, chiamati anche polimorfonucleati (PMN), intervengono nella infiammazione acuta, migrano rapidamente nei tessuti danneggiati dove hanno vita breve.
La loro funzione è la fagocitosi dei patogeni e la secrezione dei mediatori dell’infiammazione
· I Granulociti eosinofili attivi nelle infestazioni da parassiti e nelle reazioni allergiche.
· Granulociti basofili che intervengono nelle reazioni allergiche
· Monociti circolanti nel sangue che migrano nei tessuti. Intervengono nella fase tardiva della infiammazione acuta e nella infiammazione cronica. La loro funzione è la fagocitosi dei patogeni con secrezione di mediatori infiammatori.
· Cellule natural killer (NK) sono una classe di linfociti in grado di uccidere le cellule infettate da virus e le cellule tumorali in particolare dopo stimolazione con Interferon- (IFN- )
· Cellule dendritiche di natura tissutale hanno funzioni di riconoscimento, fagocitosi e digestione di elementi non self con isolamento degli antigeni. Migrazione agli organi linfoidi secondari per presentare gli antigeni ai linfociti.
Vengono perciò chiamate anche cellule presentanti l’antigene (antigen presenting cell, APC).
Si riconoscono diversi sottotipi di Cellule Dendritiche (DC): classiche o mieloidi (cDC), plasmacitoidi (pDC), derivate da monociti (MoDC), Cellule di Langerhans (LC).
Le cellule dendritiche (pDC) sono dotate di modesta capacità stimolatoria sui linfociti T mediante presentazione antigenica, mentre è assolutamente significativo il meccanismo attivatorio mediato dalla sintesi e rilascio di interferoni di tipo I (interferon alpha e beta). La produzione di Interferoni è una prima linea di difesa molto importante soprattutto nelle infezioni virali. Molti virus hanno però evoluto meccanismi di evasione per evitare che venissero eliminati da queste molecole che sono considerate antivirali naturali.
· Il Sistema del complemento che è costituito da un insieme con gli anticorpi, è un elemento essenziale del sistema immunitario nei meccanismi di difesa umorale contro gli agenti infettivi. Si tratta di un sistema di mediazione umorale, costituito da circa 30 proteine circolanti nel sangue e di membrana, capaci di interagire reciprocamente e con le membrane cellulari. Nel sangue, le proteine sono presenti come molecole funzionalmente inattive; dopo l’attivazione, esse sono capaci di interagire tra loro, con gli anticorpi o con le membrane cellulari, svolgendo molteplici attività biologiche che comprendono l’uccisione delle cellule.
L’attivazione a cascata delle sue proteine solubili, che convenzionalmente vengono chiamate componenti, è alla base di attività biologiche varie come la lisi cellulare, batterica o virale; tali componenti si introducono nelle membrane degli agenti patogeni provocando su di esse pori che portano alla lisi. Durante l’attivazione del complemento si ha inoltre il reclutamento di varie cellule immunocompetenti, come cellule fagocitarie (monociti, macrofagi, polinucleati), linfociti B e T.
Il risultato dell’attivazione del sistema del complemento porta a uccisione diretta dei batteri, neutralizzazione dei virus, attrazione di cellule immuni, supporto per le cellule immuni per l‘identificazione e distruzione dei batteri, promozione per la formazione di anticorpi ed aumento dell’efficacia degli anticorpi.
È costituita dai Linfociti T e B.
Linfociti T citotossici (CD8): capaci di uccidere le cellule infettate.
Linfociti T Helper (CD4): capaci di attivare altre cellule del sistema immune come macrofagi e linfociti B. essi svolgono attivita immunoregolatorie (Treg), individuali (clonali) attraverso recettori dei linfociti T Antigene-specifico (TCR).
Linfociti B conferiscono una memoria immunologica a lungo termine.
L’ultimo stadio evolutivo dei linfociti B, sono le plasmacellule che producono e secernono anticorpi specifici (fino a 2000/sec.). Questi anticorpi (immunoglobuline) possono essere associati alla membrana dei linfociti B con la funzione di recettore di membrana per l’antigene (BCR). Sono anticorpi secreti capaci di neutralizzare le tossine, nonché di prevenire l’ingresso dei patogeni nelle cellule dell’ospite (IgM, IgG,IgA, IgE)
Le immunoglobuline, dette anche anticorpi, sono molecole glicoproteiche che vengono prodotte dai linfociti B. Si legano a uno specifico antigene e ne agevolano l’eliminazione. Sono suddivise in cinque differenti classi:
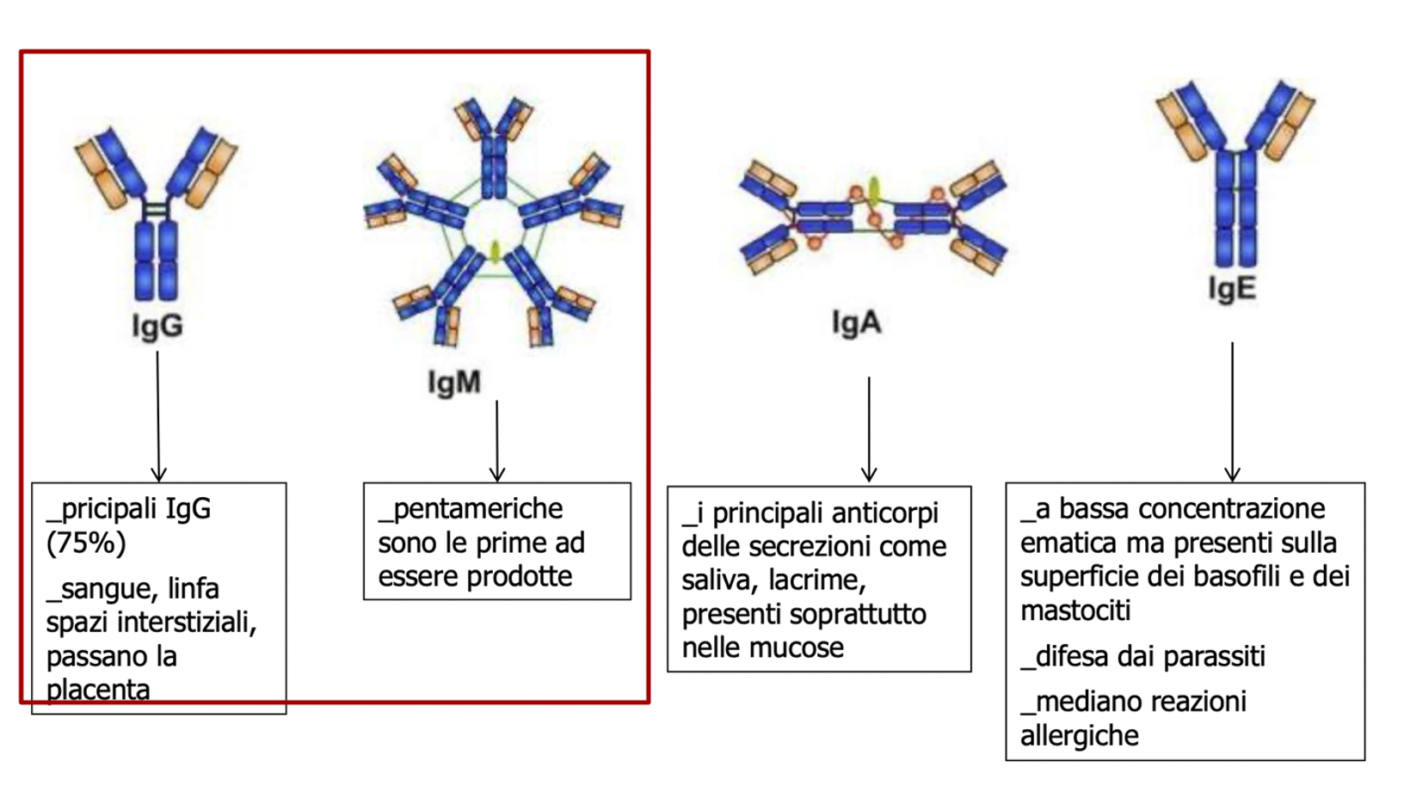
Gli anticorpi neutralizzanti, su cui fino ad ora ci si è concentrati, legano solo alcune regioni sulla proteina spike di SARS-CoV-2, ma quando questi siti subiscono delle mutazioni, la protezione anticorpale svanisce.
Le cellule T, invece, sono più resistenti. Esse svolgono una varietà di funzioni immunitarie, tra cui agire come cellule killer che distruggono le cellule infettate dal virus. Uccidendo le cellule infette, le cellule T possono limitare la diffusione dell’infezione e potenzialmente ridurre la possibilità di malattie gravi.
I livelli di cellule T non tendono a diminuire tanto rapidamente quanto gli anticorpi dopo un’infezione o una vaccinazione. E poiché possono riconoscere molti più siti sulla proteina spike rispetto agli anticorpi, queste cellule sono in grado di rilevare meglio le varianti mutate. Quella che sembra una quantità enorme di mutazioni non intacca la risposta delle cellule T.
In tema di immunità verso il coronavirus, gli anticorpi si sono presi il centro della scena. I ricercatori si stanno affannando a monitorare i livelli di anticorpi delle persone, in particolare degli anticorpi neutralizzanti, che impediscono direttamente al virus di replicarsi. Questi anticorpi sono molto efficaci nel combattere l’infezione poiché si legano a una regione specifica della proteina spike del virus, chiamata RBD, Receptor Binding Domain (si tratta di un’area recettrice che permette al virus di agganciarsi alle cellule umane).
Sono questi gli anticorpi che vengono stimolati dai vaccini anti-COVID. il test sugli anticorpi neutralizzanti non aiuta a capire quando si ci è infettati o a quando risale la prima produzione di anticorpi, perché misura tutti gli anti-RBD: IgM (quelli prodotti nel corso dell’infezione), IgG e IgA (prodotti nelle settimane successive).
Gli esami sierologici classici, invece, individuano gli anticorpi che riconoscono la proteina spike, senza differenziare tra regioni, come fanno piuttosto gli anti-RBD. Il vantaggio di questo test è poter valutare separatamente gli anticorpi IgG o IgM. E questo, a differenza del test anti-RBD, può fornirci almeno un’indicazione temporale di quando è avvenuta l’infezione, anche se non è utile per stimare l’efficacia protettiva degli anticorpi.
Un calo dei livelli di questi anticorpi è correlato a un aumento del rischio di infezione sintomatica. La tendenza a studiare gli anticorpi più che le cellule T è correlato alla maggiore facilità di dosaggio dei primi (anticorpi) rispetto ai secondi (linfociti T), il che agevola l’analisi in grandi studi internazionali sui vaccini, ma come abbiamo visto grande spazio dobbiamo cominciare a dare ai linfociti T che svolgono una molteplicità di funzioni con conseguente limitazione della diffusione virale e riduzione della possibilità di andare verso la malattia grave.
Geurts van Kessel così conclude:
“Siamo interessati al grado d’infettività? Allora gli anticorpi potrebbero essere la misura più importante da ottenere, ma se siamo più interessati alla malattia grave allora le cellule T diventano molto più importanti.”
Barouch sospetta infatti che le cellule T siano responsabili dell’efficacia dei vaccini prodotti da Pfizer-BioNTech e da Janssen nel prevenire l’ospedalizzazione dovuta all’infezione da Omicron. “Nessuno di questi vaccini ha suscitato livelli elevati di anticorpi neutralizzanti contro Omicron”, afferma. “A mio parere, i dati di efficacia che stiamo vedendo emergere in Sudafrica sono probabilmente dovuti alle cellule T”.
In questo ambito possiamo valutare le risposte ai vaccini per il Covid 19: alcune persone non sviluppano affatto anticorpi o ne producono in percentuale molto bassa, questo non vuol dire che non siano protetti dalla malattia grave. Lo scorso maggio la Fda (Food and Drug Administration) ha stabilito che la ricerca degli anticorpi (o immunoglobuline) contro la proteina Spike non è un mezzo assoluto per escludere o validare la presenza dell’immunità nei confronti di Sars-CoV-2.
La protezione nei confronti del virus si realizza infatti sia attraverso una risposta umorale, basata su anticorpi, che su quella cellulo-mediata, quindi dobbiamo rifiutare l’equazione: “niente anticorpi, niente protezione”.
C’è una grande confusione sui test di dosaggio degli anticorpi sviluppati per il Covid 19. Attraverso essi è possibile differenziare gli anticorpi generati dal vaccino e quelli dalla malattia naturale facciamo chiarezza:
| Test per anticorpi neutralizzanti | si legano a una regione specifica della proteina spike del virus, chiamata RBD, Receptor Binding Domain | non aiuta a capire quando si ci è infettati o a quando risale la prima produzione di anticorpi, perché misura tutti gli anti-RBD: IgM (quelli prodotti nel corso dell’infezione), IgG e IgA (prodotti nelle settimane successive). |
| Test sierologici quantitativi | valutare separatamente gli anticorpi IgG o IgM. | E questo, a differenza del test anti-RBD, può fornirci almeno un’indicazione temporale di quando è avvenuta l’infezione, anche se non è utile per stimare l’efficacia protettiva degli anticorpi. |
| Test sierologici qualitativi | misura la qualità degli anticorpi anti-nucleocapside del virus | ha il vantaggio di individuare gli anticorpi che riconoscono il nucleocapside (la proteina N che protegge il genoma del virus), prodotti solo dall’infezione naturale (e non dai vaccini) |
| Valutazione della memoria immunologica | Linfociti T + cellule B della memoria | i linfociti T formano la memoria cellulare che ha un ruolo fondamentale nella risposta contro SARS-Cov-2, |
1 Comment

Grazie Prof,molto interessante